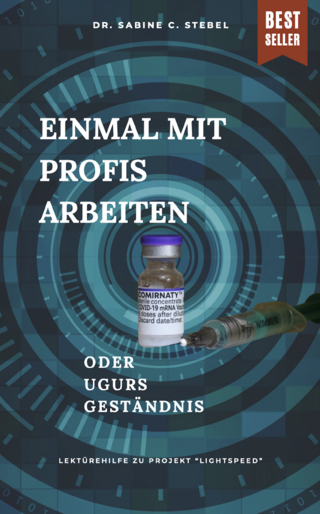
GMP für Wirkstoffe. EU-GMP-Leitfaden II
Good Manufacturing Practice Part II
Seiten
2008
|
3., überarb. Aufl.
Maas & Peither GMP (Verlag)
978-3-934971-43-1 (ISBN)
Maas & Peither GMP (Verlag)
978-3-934971-43-1 (ISBN)
Lese- und Medienproben
- Titel ist leider vergriffen;
keine Neuauflage - Artikel merken
1. EINLEITUNG: 1.1 Zielsetzung, 1.2 Geltungsbereich
2. QUALITÄTSMANAGEMENT: 2.1 Grundsätze, 2.2 Verantwortlichkeiten der Qualitäts(sicherungs)-einheit(en), 2.3 Verantwortung für Produktionsaktivitäten, 2.4 Interne Audits (Selbstinspektion), 2.5 Produktqualitätsüberprüfung
3. PERSONAL: 3.1 Qualifikationen des Personals, 3.2 Personalhygiene, 3.3 Berater
4. GEBÄUDE UND ANLAGEN: 4.1 Design und Bauart, 4.2 Betriebsmittel, 4.3 Wasser, 4.4 Containment (separate Bereiche), 4.5 Beleuchtung, 4.6 Abwasser und Abfall, 4.7 Betriebshygiene und Wartung
5. PROZESSAUSRÜSTUNG: 5.1 Design und Bauart, 5.2 Wartung und Reinigung der Ausrüstung, 5.3 Kalibrierung, 5.4 Computergestütze Systeme
6. DOKUMENTATION UND PROTOKOLLE: 6.1 Dokumentationssysteme und Spezigikationen, 6.2 Reinigung der Ausrüstung und Protokolle über den Gebrauch, 6.3 Protokolle über Rohmaterialien, Zwischenprodukte, Kennzeichnungs- und Verpackungsmaterialien der Wirkstoffe, 6.4 Muster-Herstellungsanweisungen (Muster-Herstellungs-und Kontrollberichte), 6.5 Chargenprotokolle (Protokolle über die Chargenherstellung und -prüfung), 6.6 Prüfprotokolle, 6.7 Überprüfung der Chargenkontrolle
7. MATERIALMANAGEMENT: 7.1 Allgemeine Kontrollen, 7.2 Wareneingang und Quarantäne, 7.3 Probenahme und Prüfung eingehender Materialien für die Produktion, 7.4 Lagerung, 7.5 Nachbewertung
8. PRODUKTION UND INPROZESSKONTROLLEN: 8.1 Produktionsaktivitäten, 8.2 Zeitbegrenzung, 8.3 Inprozessprobenahmen und -kontrollen, 8.4 Mischen (Verschneiden) von Zwischenprodukt- oder Wirkstoffchargen, 8.5 Kontaminationskontrolle
9. VERPACKUNG UND KENNZEICHNUNG ZUR IDENTIFIZIERUNG VON WIRKSTOFFEN UND ZWISCHENPRODUKTEN: 9.1 Allgemeine Anforderungen, 9.2 Verpackungsmaterialien, 9.3 Vergabe von Etiketten und Kontrolle, 9.4 Verpackungs-und Kennzeichnungsvorgänge
10. LAGERUNG UND VERTRIEB: 10.1 Lagerverfahren, 10.2 Vertriebsverfahren
11. LABORKONTROLLEN: 11.1 Allgemeine Kontrollen, 11.2 Prüfungen von Zwischenprodukten und Wirkstoffen, 11.3 Validierung von Prüfverfahren- vgl. Abschnitt 12, 11.4 Analysenzertifikate, 11.5 Stabilitätsmonitoring bei Wirkstoffen, 11.6 Festlegen von Verfalls-und Wiederholungstestdatum, 11.7 Rückhalte-/Rückstellmuster
12. VALIDIERUNG: 12.1 Validierungspolitik, 12.2 Validierungsdokumentation, 12.3 Qualifizierung, 12.4 Vorgehensweisen bei der Prozessvalidierung, 12.5 Prozessvalidierungsprogramm, 12.6 Periodischer Überprüfung validierter Systeme, 12.7 Reinigungsvalidierung, 12.8 Validierung von Prüfverfahren
13. ÄNDERUNGSKONTROLLE
14. ZURÜCKWEISUNG UND WIEDERVERWENDUNG VON MATERIALIEN: 14.1 Zurückweisung, 14.2 Aufarbeitung (reprocessing), 14.3 Umarbeitung (reworking), 14.4 Rückgewinnung von Materialien und Lösungsmitteln, 14.5 Rückgaben
15. BEANSTANDUNGEN UND RÜCKRUFE
16. LOHNHERSTELLER (EINSCHLIEßLICH LABORS)
17. VERTRETER, MAKLER, HÄNDLER, GROßHÄNDLER, UMVERPACKER UND UMETIKETTIERER: 17.1 Anwendbarkeit, 17.2 Rückverfolgbarkeit vertriebener Wirkstoffe und Zwischenprodukte, 17.3 Qualitätsmanagement, 17.4 Umverpackungen, Umetikettierungen und Lagerung von Wirkstoffen und Zwischenprodukte, 17.5 Stabilität, 17.6 Weitergabe von Informationen, 17.7 Umgang mit Beanstandungen und Rückrufen, 17.8 Umgang mit Retouren
18. SPEZ. ANLEITUNG FÜR WIRKSTOFFE, DIE MIT HILFE VON ZELLKULTUREN/FERMENTATION HERGESTELLT WERDEN: 18.1 Allgemeine Anforderungen, 18.2 Zellbankwartung und -protokollierung, 18.3 Zellkultur/Fermentation. 18.4 Ernte, Isolierung und Reinigung, 18.5 Schritte zur Virusentfernung und -inaktivierung
19. WIRKSTOFFE ZUR VERWENDUNG IN KLINISCHEN PRÜFUNGEN: 19.1 Allgemeine Anforderungen, 19.2 Qualität, 19.3 Ausrüstung und Anlagen, 19.4 Prüfung von Rohmaterialien, 19.5 Produktion, 19.6 Validierung, 19.7 Änderungen, 19.8 Prüfung, 19.9 Dokumentation
2. QUALITÄTSMANAGEMENT: 2.1 Grundsätze, 2.2 Verantwortlichkeiten der Qualitäts(sicherungs)-einheit(en), 2.3 Verantwortung für Produktionsaktivitäten, 2.4 Interne Audits (Selbstinspektion), 2.5 Produktqualitätsüberprüfung
3. PERSONAL: 3.1 Qualifikationen des Personals, 3.2 Personalhygiene, 3.3 Berater
4. GEBÄUDE UND ANLAGEN: 4.1 Design und Bauart, 4.2 Betriebsmittel, 4.3 Wasser, 4.4 Containment (separate Bereiche), 4.5 Beleuchtung, 4.6 Abwasser und Abfall, 4.7 Betriebshygiene und Wartung
5. PROZESSAUSRÜSTUNG: 5.1 Design und Bauart, 5.2 Wartung und Reinigung der Ausrüstung, 5.3 Kalibrierung, 5.4 Computergestütze Systeme
6. DOKUMENTATION UND PROTOKOLLE: 6.1 Dokumentationssysteme und Spezigikationen, 6.2 Reinigung der Ausrüstung und Protokolle über den Gebrauch, 6.3 Protokolle über Rohmaterialien, Zwischenprodukte, Kennzeichnungs- und Verpackungsmaterialien der Wirkstoffe, 6.4 Muster-Herstellungsanweisungen (Muster-Herstellungs-und Kontrollberichte), 6.5 Chargenprotokolle (Protokolle über die Chargenherstellung und -prüfung), 6.6 Prüfprotokolle, 6.7 Überprüfung der Chargenkontrolle
7. MATERIALMANAGEMENT: 7.1 Allgemeine Kontrollen, 7.2 Wareneingang und Quarantäne, 7.3 Probenahme und Prüfung eingehender Materialien für die Produktion, 7.4 Lagerung, 7.5 Nachbewertung
8. PRODUKTION UND INPROZESSKONTROLLEN: 8.1 Produktionsaktivitäten, 8.2 Zeitbegrenzung, 8.3 Inprozessprobenahmen und -kontrollen, 8.4 Mischen (Verschneiden) von Zwischenprodukt- oder Wirkstoffchargen, 8.5 Kontaminationskontrolle
9. VERPACKUNG UND KENNZEICHNUNG ZUR IDENTIFIZIERUNG VON WIRKSTOFFEN UND ZWISCHENPRODUKTEN: 9.1 Allgemeine Anforderungen, 9.2 Verpackungsmaterialien, 9.3 Vergabe von Etiketten und Kontrolle, 9.4 Verpackungs-und Kennzeichnungsvorgänge
10. LAGERUNG UND VERTRIEB: 10.1 Lagerverfahren, 10.2 Vertriebsverfahren
11. LABORKONTROLLEN: 11.1 Allgemeine Kontrollen, 11.2 Prüfungen von Zwischenprodukten und Wirkstoffen, 11.3 Validierung von Prüfverfahren- vgl. Abschnitt 12, 11.4 Analysenzertifikate, 11.5 Stabilitätsmonitoring bei Wirkstoffen, 11.6 Festlegen von Verfalls-und Wiederholungstestdatum, 11.7 Rückhalte-/Rückstellmuster
12. VALIDIERUNG: 12.1 Validierungspolitik, 12.2 Validierungsdokumentation, 12.3 Qualifizierung, 12.4 Vorgehensweisen bei der Prozessvalidierung, 12.5 Prozessvalidierungsprogramm, 12.6 Periodischer Überprüfung validierter Systeme, 12.7 Reinigungsvalidierung, 12.8 Validierung von Prüfverfahren
13. ÄNDERUNGSKONTROLLE
14. ZURÜCKWEISUNG UND WIEDERVERWENDUNG VON MATERIALIEN: 14.1 Zurückweisung, 14.2 Aufarbeitung (reprocessing), 14.3 Umarbeitung (reworking), 14.4 Rückgewinnung von Materialien und Lösungsmitteln, 14.5 Rückgaben
15. BEANSTANDUNGEN UND RÜCKRUFE
16. LOHNHERSTELLER (EINSCHLIEßLICH LABORS)
17. VERTRETER, MAKLER, HÄNDLER, GROßHÄNDLER, UMVERPACKER UND UMETIKETTIERER: 17.1 Anwendbarkeit, 17.2 Rückverfolgbarkeit vertriebener Wirkstoffe und Zwischenprodukte, 17.3 Qualitätsmanagement, 17.4 Umverpackungen, Umetikettierungen und Lagerung von Wirkstoffen und Zwischenprodukte, 17.5 Stabilität, 17.6 Weitergabe von Informationen, 17.7 Umgang mit Beanstandungen und Rückrufen, 17.8 Umgang mit Retouren
18. SPEZ. ANLEITUNG FÜR WIRKSTOFFE, DIE MIT HILFE VON ZELLKULTUREN/FERMENTATION HERGESTELLT WERDEN: 18.1 Allgemeine Anforderungen, 18.2 Zellbankwartung und -protokollierung, 18.3 Zellkultur/Fermentation. 18.4 Ernte, Isolierung und Reinigung, 18.5 Schritte zur Virusentfernung und -inaktivierung
19. WIRKSTOFFE ZUR VERWENDUNG IN KLINISCHEN PRÜFUNGEN: 19.1 Allgemeine Anforderungen, 19.2 Qualität, 19.3 Ausrüstung und Anlagen, 19.4 Prüfung von Rohmaterialien, 19.5 Produktion, 19.6 Validierung, 19.7 Änderungen, 19.8 Prüfung, 19.9 Dokumentation
| Reihe/Serie | Kleiner GMP-Berater ; 2 |
|---|---|
| Sprache | englisch; deutsch |
| Maße | 100 x 140 mm |
| Gewicht | 210 g |
| Einbandart | Schnellhefter |
| Themenwelt | Medizin / Pharmazie ► Pharmazie |
| Schlagworte | EU Leitfaden • GMP • Taschenbuch / Medizin/Pharmazie • TB/Medizin/Pharmazie • Wirkstoffe |
| ISBN-10 | 3-934971-43-1 / 3934971431 |
| ISBN-13 | 978-3-934971-43-1 / 9783934971431 |
| Zustand | Neuware |
| Informationen gemäß Produktsicherheitsverordnung (GPSR) | |
| Haben Sie eine Frage zum Produkt? |
Mehr entdecken
aus dem Bereich
aus dem Bereich
mikroskopisches Praktikum
Buch | Softcover (2025)
Deutscher Apotheker Verlag
CHF 39,20
Pharmaceuticals, Diagnostics, Medical Devices
Buch | Hardcover (2023)
Wiley-VCH (Verlag)
CHF 138,60